Амины.
Амины - производные аммиака, у которых один, два или все три атома водорода замещены на радикалы.
Классификация аминов : амины классифицируются по двум признакам:
1) по числу радикалов, замещающих атом водорода в аммиаке амины подразделяются на:
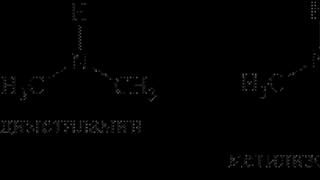
-первичные :
-вторичные :

-третичные :
2) по характеру радикалов, связанных с атомом азота, амины подразделяются на :
- алифатические . Алифатическими аминами называются такие амины, радикалами в которых являются остатки алканов, алкенов, алкадиенов, но не аренов:
пропиламин 2-пропениламин 2-пропиниламин
К алифатическим относятся также амины, имеющие в своей структуре ароматические фрагменты, если они отделены от атома азота по крайней мере одной группой - СН 2 -, например, бензиламин:

- ароматические . Ароматическими считаются только такие амины, у которых атом азота непосредственно связан с ароматическим ядром, например:

- жирноароматические : в этих аминах, если они третичные, атом азота соединён с одним алифатическим и с двумя ароматическими радикалами или, наоборот, с одним ароматическим и двумя алифатическими радикалами, например:

Если жирноароматический амин вторичный, то у него один радикал алифатический, а другой ароматический, например:

Изомерия и номенклатура алифатических аминов
Чтобы назвать алифатический амин по номенклатуре ИЮПАК нужно выбрать самую длинную цепь из атомов углерода, контактирующую с аминогруппой. Пронумеровать цепь с той стороны, к которой ближе находится аминогруппа. Затем указать номер атома, связанного с атомом азота, и через дефис написать «амино». После этого указать номера атомов главной цепи и названия углеводордных радикалов, связанных с ними. В конце слитно с названием последнего из радикалов дать название алкана, соответствующего главной цепи.
По рациональной номенклатуре называют сначала по мере усложнения радикалы, связанные с азотом, а затем приписывают слитно слово «амин». Ниже в таблице представлены примеры названий для аминов с формулой С 5 Н 13 N
| ИЮПАК | Рациональная | |
 | 1-аминопентан | амиламин |
 | 2-аминопентан | 1-метилбутиламин |
 | 3-аминопентан | 1-этилпропиламин |
 | 1-амино-2-метилбутан | 2-метилбутиламин |
 | 2-амино-2метилбутан | Трет -амиламин |
 | 2-амино-3-метилбутан | 1,2-диметилпропиламин |
 | 1-амино-3-метилбутан | Изоамиламин |
 | 1-амино-2,2-диметилпропан | Неопентиламин |
 | 1-(N-метил)аминобутан | Метилбутиламин |
 | 2-(N-метил)аминобутан | Метил-втор -бутиламин |
 | 1-(N-метил)амино-2-метилпропан | Метилизобутиламин |
| 2-(N-метил)амино-2-метилпропан | Метил-трет.-бутиламин | |
 | 1-(N-метил- N -этил)аминоэтан | Метилдиэтиламин |
 | 1-(N,N-диметил)аминопропан | Диметилпропиламин |
 | 2-(N,N-диметил)аминопропан | Диметилизопропиламин |
Способы получения аминов.
Получение аминов из других азотсодержащих соединений.
Из нитросоединений амины могут быть получены путём их гидрирования водородом на катализаторе – никеле Ренея. Этот катализатор получают выщелачиванием алюминия из его сплава с никелем по реакции:
1-нитропропан 1-аминопропан
Аналогичным образом первичные амины могут быть получены из нитрозосоединений:
2-нитрозобутан 2-аминобутан
Амины могут быть получены также из оксимов . Сами оксимы легко получаются из альдегидов или кетонов путём их реакции с гидроксиламином:
пропаналь гидроксиламин оксим пропаналя
При гидрировании оксимов происходит разрыв связи N – O и получаются амин (всегда первичный) и вода:
оксим пропаналя пропиламин
Первичные амины могут быть получены также из гидразонов , которые в свою очередь получаются при действии гидразина на альдегиды или кетоны
бутанон гидразин гидразон бутанона
При гидрированиигидразонов происходит разрыв связи N – N и получаются амин (всегда первичный) и аммиак:
2-аминобутан
Из амидов карбоновых кислот такжеможно получитьамины, причём не только первичные, но из алкиламидов – вторичные и из диалкиламидов – третичные амины.
Сначала из карбоновых кислот действием аммиака получают аммонийые соли ,например:

пропионовая кислота пропионат аммония
При нагревании аммонийной соли выше 100 о С выделяется вода в виде пара и образуется амид:

пропионат аммония амид пропионовой кислоты
Гидрирование амидов на катализаторах платиновой группы приводит к получению первичных аминов и воды:
пропиоамид пропиламин
Если вместо аммиака в первую из приведённых выше реакций взять первичный амин , то после гидрирования амида получится вторичный амин :
уксусная кислота 1-аминопропан ацетат пропиламмония
пропиламид уксусной кислоты
Этилпропиламин – вторичный амин
Если же вместо аммиака в первую из трёх этих реакций взять вторичный амин , то после гидрирования амида получится третичный амин :

3-метилбутановая кислота метилизобутиламин
1. Синтез из спиртов. Пропусканием паров спирта и аммиака при 400 0 С над катализатором получают смесь первичных, вторичных и третичных спиртов:
2. Реакция Гофмана. Действие аммиака на галогенпроизводные позволяет получить смесь солей различных аминов:
3. Реакция Зинина. Нитросоединения восстанавливаются водородом в присутствии катализатора:
4. Восстановление нитрилов:
5. Синтез из амидов кислот:
6. Взаимодействие хлорбензола с аммиаком:
Кислотно-основные свойства аминов. Амины обладают ярко выраженными основными свойствами. Это типичные основания по теории Бренстеда, согласно которой к основаниям относятся структуры, склонные присоединять протон. В ряду алифатических аминов более ярко выражены основные свойства у третичного амина, что объясняется донорным индукционным эффектом алкильных групп (R), что увеличивает электронную плотность на азоте и способность азота присоединять протон выражена ярче.
В ряду ароматических аминов более ярко выраженными основными свойствами обладает анилин и соблюдается следующая последовательность:
Химические свойства. В химическом отношении амины очень сходны с аммиаком и вступают в различные реакциии, как нуклеофильные реагенты. Типичными реакциями аминов являются реакции по аминогруппе.
1. Присоединение хлороводорода:
2. Присоединение воды:
3. Алкилирование:
4. Реакция ацелирования:
5. Реакция диазотирования:
Охлажденные растворы диазосолей используются для получения азокрасителей. В качестве азосоставляющей в реакциях азосочетания используются фенолы или ароматические амины.
Реакция азосочетания:
Реакцию азосочетания можно рассматривать как реакцию электрофильного замещения в ароматическом бензольном кольце. Электрофильной частицей выступает диазокатион и замещение идет преимущественно в пара-положение.
Полученный продукт является красителем. Красителями называют органические соединения, обладающие окраской и способные окрашивать различные ткани. Красители должны обязательно содержать в своем составе хромоформные группы:
и иметь высокую степень сопряжения в молекуле.
Для того, чтобы краситель связывался с тканью, в его составе должны быть ауксохромные группы: OH, NH 2 , СН 3 .
Амины могут быть получены различными способами.
А) Действием на аммиак галогеналкилами
2NH 3 + CH 3 I ––® CH 3 – NH 2 + NH 4 I
Б) Каталитическое гидрирование нитробензола молекулярным водородом:
С 6 Н 5 NО 2 ––® С 6 Н 5 NН 2 + Н 2 О
нитробензол кат анилин
В) Получение низших аминов (С 1 –С 4) путем алкилирования спиртами:
350 0 C, Al 2 O 3
R–OH + NH 3 –––––––––––® R–NH 2 +H 2 O
350 0 C, Al 2 O 3
2R–OH + NH 3 –––––––––––® R 2 –NH +2H 2 O
350 0 C, Al 2 O 3
3R–OH + NH 3 –––––––––––® R 3 –N + 3H 2 O
Конец работы -
Эта тема принадлежит разделу:
Химия – наука, изучающая вещества и процессы их превращения. Объекты изучения в химии - химические элементы и их соединения
Химический элемент это совокупность атомов с одинаковым зарядом ядер атом наименьшая частица химического элемента сохраняющая его свойства.. химия нужна человечеству чтобы получать из веществ природы по возможности все.. химию можно рассматривать в двух аспектах описательном открытие химических фактов и явлений и их описание и..
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
Периодический закон и Периодическая система химических элементов
Открытие Периодического закона Основной закон химии - Периодический закон был открыт Д.И. Менделеевым в 1869 году в то время, когда атом считался неделимым и о его внутреннем строении ничего
Квантовомеханическое описание состояния электрона в атоме
Как известно, свет проявляет свойства как потока частиц, так и электромагнитной волны, т.е. фотоны обладают корпускулярно-волновой двойственностью. Создание квантовой механики произошло на пути обо
Атомные орбитали
Состояние электрона в атоме, характеризующееся тремя квантовыми числами n, l, ml , называется атомной орбиталью.Часто орбиталь также определяют как область пространства, в кото
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором
При растворении кристаллов происходит их разрушение, что требует затраты энергии, поэтому растворение должно было бы всегда протекать с поглощением теплоты. Однако, как было ранее отмечено, некот
Способы выражения концентрации растворов
Под концентрацией раствора понимают содержание растворённого вещества в определённом объёме или массе раствора или растворителя. Растворы с большой концентрацией растворённого вещества называются к
Константа химического равновесия
При равновесии химической реакции:
bB + dD = lL + mM
или,
где pp,L, ppM, pp,D, ppB –равновесные парциальные давления веществ, а
Принцип Ле Шателье
Так как почти все реакции в той или иной степени обратимы, в промышленности и лабораторной практике возникают две проблемы: как получить продукт " полезной" реакции с максимальным выходом
Скорость химических реакций
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ:
V = ± ((С2 – С1) / (t2 - t1)) = ± (DС / Dt)
Основные положения теории электролитической диссоциации
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные.
2. Под действием электрического тока ионы приобретают направленное движение: полож
Истинные и потенциальные электролиты
Процесс распада вещества на ионы при растворении или расплаве называется ЭД. Механизм ЭД зависит от типа электролита: следует различать истинные и потенциальные электролиты.
Константа диссоциации. Степень диссоциации
Концентрации ионов в растворах слабых электролитов качественно характеризуют степень и константой диссоциации.
Степень диссоциации - это отношение числа молекул, распавшихся на ионы
Ионные реакции
Реакции ионного обмена -это реакции между ионами, образовавшимися в результате диссоциации электролитов
Правила составления ионных уравнений реакций
1.Нерастворим
Ионные произведения воды. водородный показатель. буферные растворы
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН.
Водородный показатель численно равен отр
Гидролиз солей. Константа, степень и ph гидролиза
Под гидролизом солей подразумеваются процессы реакций между молекулами воды и молекулами растворенных в ней солей. В результате подобной реакции образовываются малодиссоциированные соединения. Проц
Окислительно восстановительные реакции. Понятие окисления, восстановление, окислитель, восстановитель
Окислительно-восстановительные реакции играют огромную роль в природе и технике. Без этих реакций невозможна жизнь, потому что дыхание, обмен веществ, синтез растениями клетчатки из углекислого газ
Составление уравнений окислительно-восстановительных реакций (метод электронного баланса, метод полуреакций)
Метод электронного баланса. Уравнения ОВР часто имеют сложный характер, их составление, в частности, расстановка стехиометрических коэффициентов, представляет собой при этом трудную задачу.
Предмет органической химии. Исторический обзор развития органической химии. Первые теорритические воззрения. Теория строения А. М. Бутлерова
Органической химией изначально называлась химия веществ, полученных из организмов растений и животных. С такими веществами человечество знакомо с глубокой древности. Люди умели получать уксус из пр
Физические и химические свойства алканов. Метод получения и идентификации алканов. Отдельные представители
Алканы - бесцветные вещества, нерастворимые в воде. В обычных условиях они химически инертны, так как все связи в их молекулах образованы с участием sp3-гибридных орбиталей атома углерода и являютс
Физические и химические свойства алкенов. Методы получения и идентификации алкенов. Отдельные представители
Физические свойства некоторых алкенов показаны в табл. 1. Первые три представителя гомологического ряда алкенов (этилен, пропилен и бутилен) - газы, начиная с C5H10 (ам
Эффект сопряжения. Физические и химические свойства диенов. Методы получения и идентификации диенов. Отдельные представители
1. Получение диенов
Из диеновых углеводородов особое значение имеют дивинил (бута-диен-1,3) и изопрен (2-метилбутадиен-1,3). Рассмотрим основные способы получения этих диенов.
Физические и химические свойства аренов. Методы получения и идентификации. Отдельные представители
Физические свойства. Первые члены гомологического ряда бензола (например, толуол, этилбензол и др.) - бесцветные жидкости со специфическим запахом. Они легче воды и нерастворимы в ней. Хорош
Номенклатура спиртов
Для спиртов существует несколько способов их названия. При названии отдельных спиртов широко применяются исторические названия (тривиальные): древесный спирт СН3О
Изомерия
Изомерия спиртов обусловлена строением углеводородного радикала и положением функциональной (гидроксильной) группы. Например, молекулярной формуле С
Физические свойства спиртов
Низшие и средние члены гомологического ряда предельных одноатомных с С1 до С11 спиртов – жидкости, высшие (начиная с С11) – твердые вещества. Плотности предельных и
Методы получения и химические свойства
3.1 Методы получения
А. Гидратация алкенов:
СН3–CH=CH2+HOН---------------------® СН3–CH–CH3
Строение гидроксильной группы
Свойства спиртов определяется строением гидроксильной группы, характером ее химических связей, строение углеводородных радикалов и их взаимным влиянием. Связи О–Н и С–О – полярные ковалентные. Элек
Химические свойства гликолей
Химические свойства гликолей и многоатомных спиртов напоминает свойства одноатомных спиртов.
Гликоли лучше, чем соответствующие одноатомные спирты, растворимы в воде и имеют несколько боле
Фенолы. Общая характеристика. Методы получения и химические свойства
Фенолами называются соединения, у которых гидроксильная группа непосредственно присоединена к ароматическому кольцу бензола. Соединения, содержащие гидроксильную группу у конденсированных ароматиче
Строение гидроксильной группы фенола
Фенольная гидроксильная группа за счет р,p-сопряжения с кольцом является электродонором, поэтому вектор диполя в феноле направлен в сторону бензольного кольца, в то время ка
Сложные эфиры (Эстеры)
Сложные эфиры - это производные карбоновых кислот, у которых гидроксильная
группа замещена на остаток спирта. Общая формула сложных эфиров - R-CO-O-R"
Номенклатура. Изомерия.
Номенклатура, изомерия аминов
1. Названия аминов по рациональной номенклатуре обычно производят от названий входящих в них углеводородных радикалов с присоединением окончания –амин: метиламин СН
Физические свойства аминов
Метиламин, диметиламин и триметиламин - газы, средние члены ряда аминов - жидкости, высшие - твердые тела. С увеличением молекулярной массы аминов увеличивается их плотность, повышается температур
Химические свойства аминов
Химическое поведение аминов определяется наличием в молекуле аминогруппы. На внешней электронной оболочке атома азота имеется 5 электронов. В молекуле амина также, как и в молекуле аммиака, атом аз
Диамины
Диамины играют важную роль в биологических процессах. Как правило, они легко растворимы в воде, обладают характерным запахом, имеют сильно щелочную реакцию, взаимодействуют с С02 возд
Аминоспирты
Аминоспирты - соединения со смешанными функциями, в молекуле которых содержатся амино- и оксигруппы.
Аминоэтанол(этаноламин) НО-СН2СН2-NH
Физические и хим свойства карбоновых кислот
Только с чисто формальных позиций можно рассматривать карбоксильную группу как комбинацию карбонильной и гидроксильной функций. Фактически их взаимное влияние друг на друга таково, что полностью из
Химические свойства
Для кислот характерны три типа реакций: замещения иона водорода карбоксильной группы (образование солей); с участием гидроксильной группы (образование сложных эфиров, галогенангидридов, ангидридов
Важнейшие представители
Муравьиная кислота - бесцветная жидкость с резким запахом. Является сильным восстановителем и окисляется до угольной кислоты. В природе свободная муравьиная кис
Изомерия
В молекулах всех природных аминокислот (за исключением глицина) у a-углеродного атома все четыре валентные связи заняты различными заместителями, такой атом углерода является асимметрическим, и по
Пространственное строение белков. Физические и химические свойства белков
Практически все белки построены из 20 a-аминокислот, принадлежащих к L-ряду, и одинаковых практически у всех организмов. Аминокислоты в белках соединены между собой пептидной связью-СО-NH-, которая
Дисахариды. физико-химические свойства, строение
Д и с а х а р и д ы. Дисахариды - это сложные сахара, каждая молекула которых при гидролизе распадается на 2 молекулы моносахарида. Иногда они используются в качестве запасных питательных ве
Полисахариды. Строение, химические свойства отдельных представителей
Общая формула полисахаридов, образованных остатками пентоз (C5H8О4)n, гексоз (C6H10О5), где n = 103 - 105. Наибольшее значение имеют производные глюкозы: крахмал и целлюлоза.
Крахмал являе
Липицы
Липиды - это жироподобные органические соединения, нерастворимые в воде, но хорошо растворимые в неполярных растворителях (эфире, бензине, бензоле, хлороформе и др.). Липиды принадлежат к пр
Строение простых липидов. Воски
Простые липиды в большинстве представлены сложными эфирами высших жирных кислот и трехатомного спирта глицерина - триглицеридами. Жирные кислоты имеют: 1) одинаковую для всех кислот группировку - к
Сложные липиды
Сложные липиды. К ним относят фосфолипиды, гликолипиды, липопротеины и др.
Фосфолипиды - триглицериды, у которых один остаток жирной кислоты замещен на остаток фосфорной кислоты. Принимают
Прогоркание (порча) жиров. Аналитическая характеристика жиров
Прогоркание жиров, проявляющееся в появлении специфического запаха и неприятного вкуса, вызвано образованием низкомолекулярных карбонильных соединений и обусловлено рядом химических процессов.
Мыла и детергенты
Общая формула твердого мыла:
Один из вариантов химического состава твёрдого мыла - C17H35COONa (жидкого - C17H35COOK).
Детергенты (detergere - очищать) - вещества, обладающие выра
Первичные и вторичные алкилгалогениды реагируют с аммиаком, образуя первичные амины. Чаще всего реакция идет по механизму Первичный амин (1) может реагировать с еще одной молекулой галоген-алкена, давая вторичный амин Аналогично, вторичные амины можно превратить в третичные (III). И наконец, третичные амины дают с галогеналканами ионные соединения, которые называют четвертичными аммониевыми солями (IV). Эта последовательность реакций показана ниже:

Таким образом можно получать первичные, вторичные и третичные амины, а также четвертичные соли, используя соответствующее количество галогеналкана. При синтезе аминов первоначально образуются соли, которые для получения свободного амина необходимо нейтрализовать. Общая схема такого синтеза выглядит следующим образом:
Далее, в уравнениях реакций, мы не будем изображать образование соли, а сразу будем писать формулу конечного амина. Нижеследующие примеры иллюстрируют тот факт, что, варьируя число молей и природу галогеналканов, можно получать самые разнообразные амины:

Восстановление амцдов и нитрилов
Сильные восстановители, такие, как алюмогидрид лития восстанавливают амиды до аминов, превращая карбонильную группу в группу Таким путем можно получать первичные, вторичные и третичные амины, в том числе ароматические:


Первичные амины можно синтезировать каталитическим гидрированием нитрилов, которые, как Вы помните, получают из галогеналканов и цианидов:
Например:

Ароматические амины (замещенные анилины) удобно получать из соответствующих нитросоединений, восстанавливая их железом или оловом в присутствии соляной кислоты. О методах получения ароматических нитросоединений и их восстановлении уже шла речь в гл. 9.
Полученные таким образом ароматические амины можно алкилировать по атому азота так же, как и другие амины:

Амины получают алкилированием аммиака галогеналканами, используя различные соотношения реагентов. Применяется также восстановление амидов и нитрилов. Ароматические амины получают восстановлением соответствующих нитросоединений.
Амины
Аминами называются органические производные аммиака, в котором один, два или все три атома водорода замещены на углеводородные радикалы (предельные, непредельные, ароматические).
Название аминов производят от названия углеводородного радикала с добавлением окончания -амин или от названия соответствующего углеводорода с приставкой амино-.
CH 3 - NH 2 CH 3 - NH - C 2 H 5
метиламин метилэтиламинмтилдифениламин

фениламин (анилин)
В зависимости от числа атомов водорода, замещенных в аммиаке на углеводородные радикалы, различают первичные, вторичные и третичные амины:
R- NH 2 R - NH - R"R - N - R”
первичный аминвторичный аминтретичный амин
Где R, R", R"" - углеводородные радикалы.
Первичные, вторичные и третичные амины можно получить, проводя алкилирование (введение алкильного радикала) аммиака. При этом происходит постепенное замещение атомов водорода аммиака на радикалы, и образуется смесь аминов:
NH 3 + CH 3 I - CH 3 NH 2 + HI
CH 3 NH 2 + CH 3 I - (CH 3) 2 NH + HI
(CH 3) 2 NH + CH 3 I - (CH 3) 2 N + HI
Обычно в смеси аминов преобладает один из них в зависимости от соотношения исходных веществ.
Для получения вторичных и третичных аминов можно использовать реакцию аминов с галогеналкилами:
(CH 3) 2 NH + C 2 H 5 Br - (CH 3) 2 NC 2 H 5 + HBr
Амины можно получить восстановлением нитросоединений. Обычно нитросоединения подвергают каталитическому гидрированию водородом:
C 2 H 5 NO 2 + 3H 2 - C 2 H 5 NH 2 + 2H 2 O
Этот метод используется в промышленности для получения ароматических аминов.
Предельные амины. При обычных условиях метил амин CH 3 NH 2 , диметиламин (CH 3) 2 NH, триметиламин (CH 3) 3 N и этиламин C 2 H 5 NH 2 - газы с запахом, напоминающим запах аммиака. Эти амины хорошо растворимы в воде. Более сложные амины - жидкости, высшие амины - твердые вещества.
Для аминов характерны реакции присоединения, в результате которых образуются алкиламиновые соли. Например, амины присоединяют галогеноводороды:
(CH 3) 2 NH 2 +HCl - [(CH 3) 2 NH 3 ]Cl
хлорид этиламмония
(CH 3) 2 NH + HBr - [(CH 3) 2 NH 2 ]Br
бромид диметиламмония
(CH 3) 3 N + HI - [(CH 3) 3 NH]I
иодид триметиламмония
Третичные амины присоединяют галогенопроизводные углеводорода с образованием тетраалкиламмониевых солей, например:
(C 2 H 5) 3 N + C 2 H 5 I - [(C 2 H 5) 4 N]I
Алкиламониевые соли растворимы в воде и в некоторых органических растворителях. При этом они диссоциируют на ионы:
[(C 2 H 5) 4 N]I = [(C 2 H 5) 4 N] + + I -
В результате водные и неводные растворы этих солей проводят электрический ток. Химическая связь в алкиламмониевых соединениях ковалентная, образованная по донорно-акцепторному механизму:

Ион метиламмония
Как и аммиак, в водных растворах амины проявляют свойства оснований. В их растворах появляются гидроксид-ионы за счет образования алкиламониевых оснований:
C 2 H 5 NH 2 + H 2 O = + + OH -
Щелочную реакцию растворов аминов можно обнаружить при помощи индикаторов.
Амины горят на воздухе с выделением CO 2 , азота и воды, например:
4(C 2 H 5) 2 NH + 27O 2 - 16CO 2 + 2N 2 + 22H 2 O
Первичные, вторичные и третичные амины можно различить, используя азотную кислоту HNO 2 . при взаимодействии этой кислоты с первичными аминами образуется спирт и выделяется азот:
CH 3 - NH 2 + HNO 2 - CH 3 - OH + N 2 +H 2 O
Вторичные амины дают азотистой кислотой нитрозосоединения, которые имеют характерный запах:
CH 3 - NH 2 - CH3 + HNO 2 - (CH 3) 2 - N=NO+H 2 O
Третичные амины не реагируют азотистой кислотой.
Анилин C 6 H 5 NH 2 является важнейшим ароматическим амином. Он представляет собой бесцветную маслянистую жидкость, которая кипит при температуре 184,4 0 С.
Анилин был впервые получен в XIX в. русским химиком-органиком Н. Н. Зининым, который использовал реакцию восстановления нитробензола сульфидом аммония (NH 4) 2 S. В промышленности анилин получают каталитическим гидрированием нитробензола с использованием медного катализатора:
C 6 H 5 - NO 2 + 3H 2 - cu -- C 6 H 5 - NH 2 + 2H 2 O
Старый способ восстановления нитробензола, который потерял промышленное значение, заключается в использовании в качестве восстановителя железа в присутствии кислоты.

По химическим свойствам анилин во многом аналогичен предельным аминам, однако по сравнению с ними является более слабым основанием, что обусловлено влиянием бензольного кольца. Свободная электронная пора атома азота, с наличием которой связаны основные свойства, частично втягивается в П - электронную систему бензольного кольца:
Уменьшение электронной плотности на атоме азота снижает основные свойства анилина. Анилин образует соли лишь с сильными кислотами. Например, с хлороводородной кислотой он образует хлорид фениламмония:
C 6 H 5 NH 2 + HCl - Cl
Азотная кислота образует с анилином диазосоединения:
C 6 H 5 - NH 2 + NaNO 2 +2HCl - Cl - + NaCl + 2H 2 O
Диазосоединения, особенно ароматические, имеют большое значение в синтезе органических красителей.
Некоторые особые свойства анилина обусловлены наличием в его молекуле ароматического ядра. Так, анилин легко взаимодействует в растворах с хлором и бромом, при этом происходит замещение атомов водорода в бензольном ядре, находящихся в орто- и пара-положенияхк аминогруппе:

Анилин сульфируется при нагревании с серной кислотой, при этом образуется сульфаниловая кислота:
Сульфаниловая кислота - важнейший промежуточный продукт при синтезе красителей и лекарственных препаратов.
Гидрированием анилина в присутствии катализаторов можно получить циклогексиламин:
C 6 H 5 - NH 2 + 3H 2 -C 6 H 11 - NH 2
Анилин используется в химической промышленности для синтеза многих органических соединений, в том числе красителей и лекарств.
Метиламин



Общие традиционные названия
Монометиламинаминометан MMA
Химическая формула CH 5 N
Молярная масса 31,1 г/моль
Физические свойства
Состояние (ст. усл.) бесцветный газ
0,23 Па·с (при 20°C)
Термические свойства
Температура плавления - 94°C
Температура кипения - 6°C
Температура вспышки 8°C
Химические свойства
Растворимость в воде 108 г/100 мл
Некоторые наиболее известные амины
Метиламин
Метиламин (CH 3 --NH 2)-- бесцветный газ с запахом аммиака, t кип? 6,32°C. Применяется для синтеза пестицидов, лекарств, красителей. Наиболее важными из продуктов являются N-Метил-2-пирролидон (NMP), метилформамид, кофеин, эфедрин и N,N"-диметилмочевина. Также является второстепенным азотистым экскретом у костных рыб.
Метиламин является типичным первичным амином. С кислотами метиламин образует соли. Реакции с альдегидами и ацеталями ведут к основаниям Шиффа. При взаимодействии со сложными эфирами или ацил хлоридами дает амиды.
Как правило, используется в виде растворов: 40% масс в воде, в метаноле, этаноле или ТГФ.
Получение
Промышленное производство метиламина основывается на взаимодействии метанола с аммиаком при высокой температуре (от 370 до 430 °C) и давлении от 20 до 30 бар. Реакция проходит в газовой фазе на гетерогенном катализаторе на основе цеолита. В качестве побочных продуктов реакции образуются также вода, диметиламин (CH 3) 2 NH и триметиламин (CH 3) 3 N:
CH 3 OH + NH 3 > CH 3 NH 2 + H 2 O
CH 3 NH 2 + CH 3 OH > (CH 3) 2 NH + H 2 O
(CH 3) 2 NH + CH 3 OH > (CH 3) 3 N + H 2 O
Чистый метиламин получают путем многократной перегонки.
Альтернативное получение метиламина основано на взаимодействии формалина с хлористым аммонием при нагревании.
Горение метиламина проходит по уравнению:
4 СH 3 NH 2 + 9 O 2 = 4 CO 2 + 10 H 2 O + 2 N 2
Диметиламин
Диметиламимн -- вторичный амин, производное аммиака, в молекуле которого два атома водорода замещены метильными радикалами. Бесцветный газ с резким неприятным запахом, легко сжижающийся при охлаждении в бесцветную жидкость. Горюч.
CH 3 --NH --CH 3
Применение
Применяется для получения веществ, используемых в производстве резины. Служит сырьём для производства гептила -- ракетного топлива. Использовался в производстве химического оружия (табуна).
|
Триэтиламин |
|
 |
|
|
Систематическое наименование |
триэтиламин |
|
Химическая формула |
|
|
Эмпирическая формула |
|
|
Молярная масса |
101,19 г/моль |
|
Физические свойства |
|
|
Состояние (ст. усл.) |
жидкость |
|
Плотность |
|
|
Термические свойства |
|
|
Температура плавления |
|
|
Температура кипения |
|
|
Температура вспышки |
|
|
Энтальпия образования (ст. усл.) |
99.58 кДж/моль |
|
Удельная теплота испарения |
|
|
Давление пара |
70 гПа (20 °C) |
|
Химические свойства |
|
|
Растворимость в воде |
13.3 г/100 мл |
|
Оптические свойства |
|
|
Показатель преломления |
|
|
Структура |
|
|
Дипольный момент |
0,66 (20 °C) Д |
|
Токсикология |
|
|
Токсичность |
Триэтиламин
Триэтиламин -- третичный амин. Химическая формула (С 2 H 5) 3 N, часто используется обозначение Et 3 N. Нашёл широкое применение, как простейший симметричный третичный амин, находящийся в жидком состоянии.
Получение
В промышленности получают совместно с этиламином, диэтиламином при парофазном аминировании этанола аммиаком над Al 2 O 3 или SiO 2 или их смесью при 350-450°C и давлении 20-200 атм либо над Ni, Co, Cu, Re и H 2 при 150-230°C и давлении 17-35 атм. Состав получаемой смеси зависит от исходных соотношений.
CH 3 CH 2 OH + NH 3 = CH 3 CH 2 NH 2 + H 2 O
CH 3 CH 2 OH + CH 3 CH 2 NH 2 = (CH 3 CH 2) 2 NH + H 2 O
CH 3 CH 2 OH + (CH 3 CH 2) 2 NH = (CH 3 CH 2) 3 N + H 2 O
Полученная смесь разделяется ректификацией
Физические свойства
При комнатной температуре представляет собой подвижную бесцветную жидкость, имеющая сильный рыбный запах, напоминающий аммиачный. Температура плавления?114,8°C, температура кипения 89,5°C. Ограниченно растворим в воде (нижняя критическая точка при T=19,1°C и 31,6% вес. триэтиламина), хорошо растворим в ацетоне, бензоле, хлороформе, смешивается с этанолом, диэтиловым эфиром. С водой образует азеотроп с т. кип. 75°C и содержащий 90% весовых триэтиламина.
Химические свойства
Как сильное органическое основание (pKa=10.87) образует кристаллические триэтиламмонийные соли с органическими и минеральными кислотами.
HCl + Et 3 N > Et 3 NH + Cl ?
В качестве основания триэтиламин широко используется в органическом синтезе, в частности при синтезе сложных эфиров и амидов из ацилхлоридов для связывания образующегося хлороводорода.
R 2 NH + R"C(O)Cl + Et 3 N > R"C(O)NR 2 + Et 3 NH + Cl ?
Также используется в реакции дегидрогалогенирования
Триэтиламин легко алкилируется, образуя четвертичные аммониевые соли
RI + Et 3 N > Et 3 NR + I ?
поэтому для создания основной среды в присутствии алкилаторов используют диизопропилэтиламин.
Применение
Катализирует образование пенополиуретанов и эпоксидных смол. Находит некоторое применение в качестве ракетного топлива. Используется в производстве гербицидов, лекарств, красок.
Для удаления первичных и вторичных аминов перегоняют над уксусным ангидридом. Сушат над КОН и перегоняют.
Безопасность
Концентрационный предел воспламенения = 1,2--8% по объёму.
Раздражает дыхательные пути, глаза и кожу, при прямом контакте может вызвать сильный ожог. ПДК=10 мг/м 3
амин производный аммиак углеводородный
Этилендиамин
Свойства
Жидкость без цвета с запахом аммиака. t kип 116,5°C, t пл 8,5°C, плотность 0,899 г/смі (20°C); Этилендиамин растворим в воде, спирте, хуже -- в эфире, нерастворим в бензоле. Является сильным основанием.
Применение
Этилендиамин применяется для получения этилендиаминтетрауксусной кислоты взаимодействием с хлоруксусной кислотой. Его соли с жирными кислотами используются как смягчающие агенты при производстве текстиля. Также этилендиамин применяется в производстве красителей, эмульгаторов, стабилизаторов латексов, пластификаторов и фунгицидов.
Получение
Токсичность
 |
|
|
Традиционные названия |
ФениламинАминобензол |
|
Химическая формула |
|
|
Эмпирическая формула |
|
|
Молярная масса |
93,13 г/моль |
|
Физические свойства |
|
|
Плотность |
1,0217 г/смі |
|
Динамическая вязкость (ст. усл.) |
3,71 Па·с(при 20 °C) |
|
Термические свойства |
|
|
Температура плавления |
|
|
Температура кипения |
|
|
Химические свойства |
|
|
Растворимость в воде |
Анилимн (фениламин) -- органическое соединение с формулой C 6 H 5 NH 2 , простейший ароматический амин. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит! Название «анилин» происходит от названия одного из растений, содержащих индиго -- Indigofera anil (современное международное название растения -- Indigofera suffruticosa).
Впервые анилин был получен в 1826 году при перегонке индиго с известью немецким химиком Отто Унфердорбеном (нем. Otto Unverdorben), который дал ему название «кристаллин».
В 1834 Ф. Pyнгe обнаружил анилин в каменно-угольной смоле и назвал «кианолом».
В 1841 Ю.Ф. Фришце получил анилин нагреванием индиго с раствором KOH и назвал его «анилином».
В 1842 анилин был получен Н.Н. Зининым восстановлением нитробензола действием (NH 4) 2 S 3 и назван им «бензидамом».
В 1843 А.В. Гофман установил идентичность всех перечисленных соединений.
Промышленное производство фиолетового красителя мовеина на основе анилина началось в 1856 году.
Химические свойства
Для анилина характерны реакции как по аминогруппе, так и по ароматическому кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок).
Получение
Восстановление железом:
4C 6 H 5 NO 2 + 9Fe + 4H 2 O >4C 6 H 5 NH 2 + 3Fe 3 O 4
Восстановление водородом в присутствии катализатора и при высокой температуре:
C 6 H 5 NO 2 + 3H 2 > C 6 H 5 NH 2 + 2H 2 O
Восстановление нитросоединений -- Реакция Зинина:
C 6 H 5 NO 2 + 3(NH 4) 2 S > C 6 H 5 NH 2 + 6NH 3 + 3S + 2H 2 O
Производство и применение
Изначально анилин получали восстановлением нитробензола молекулярным водородом; практический выход анилина не превышал 15%. При взаимодействии концентрированной соляной кислоты с железом выделялся атомарный водород, более химически активный по сравнению с молекулярным. Реакция Зинина является более эффективным методом получения анилина. В реакционную массу вливали нитробензол, который восстанавливается до анилина.
По состоянию на 2002 год, в мире основная часть производимого анилина используется для производства метилдиизоцианатов, используемых затем для производства полиуретанов. Анилин также используется при производстве искусственных каучуков, гербицидов и красителей (фиолетового красителя мовеина).
В России он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты), но в связи с ожидаемым ростом производства полиуретанов возможно значительное изменение картины в среднесрочной перспективе.
Токсичные свойства
Анилин оказывает негативное воздействие на центральную нервную систему. Вызывает кислородное голодание организма за счёт образования в крови метгемоглобина, гемолиза и дегенеративных изменений эритроцитов.
В организм анилин проникает при дыхании, в виде паров, а также через кожу и слизистые оболочки. Всасывание через кожу усиливается при нагреве воздуха или приёме алкоголя.
При лёгком отравлении анилином наблюдаются слабость, головокружение, головная боль, синюшность губ, ушных раковин и ногтей. При отравлениях средней тяжести также наблюдаются тошнота, рвота, иногда, шатающаяся походка, учащение пульса. Тяжёлые случаи отравления крайне редки. При хроническом отравлении анилином (анилизм) возникают токсический гепатит, а также нервно-психические нарушения, расстройство сна, снижение памяти и т. д.
При отравлении анилином необходимо, прежде всего, удаление пострадавшего из очага отравления, обмывание тёплой (но не горячей!) водой. Так же вдыхание кислорода с карбогеном. Также применяют кровопускание, введение антидотов (метиленовая синь), сердечнососудистые средства. Пострадавшему надо обеспечить покой.
Предельно допустимая концентрация анилина в воздухе рабочей зоны 3 мг/м3. В водоёмах (при их промышленном загрязнении) 0,1 мг/л (100 мг/м3).
Этилендиамин
Этилендиамин (1,2-диаминоэтан) H 2 NCH 2 CH 2 NH 2 -- органическое соединение класса аминов.
Свойства
Жидкость без цвета с запахом аммиака. t kип 116,5°C, t пл 8,5°C, плотность 0,899 г/смі (20 °C); Этилендиамин растворим в воде, спирте, хуже -- в эфире, нерастворим в бензоле. Является сильным основанием.
Применение: Этилендиамин применяется для получения этилендиаминтетрауксусной кислоты взаимодействием с хлоруксусной кислотой. Его соли с жирными кислотами используются как смягчающие агенты при производстве текстиля. Также этилендиамин применяется в производстве красителей, эмульгаторов, стабилизаторов латексов, пластификаторов и фунгицидов.
Получение
Основным способом синтеза этилендиамина в промышленности является взаимодействие аммиака с дихлорэтаном.
Токсичность
Этилендиамин токсичен; предельно допустимая концентрация его паров в воздухе составляет 0,001 мг/л.
Пиридин -- шестичленный ароматический гетероцикл с одним атомом азота, бесцветная жидкость с резким неприятным запахом; смешивается с водой и органическими растворителями. Пиридин -- слабое основание, дает соли с сильными минеральными кислотами, легко образует двойные соли и комплексные соединения.
История открытия
Пиридин был открыт в 1846 г. Андерсоном при исследовании костяного масла, получающегося сухой перегонкой необезжиренных костей. В 1869 г. Кернер в частном письме к Каниццаро высказал мысль, что П. может быть рассматриваем, как бензол, в котором одна группа СН замещена азотом. По мнению Кернера, подобная формула не только объясняет синтезы пиридина, но, главным образом, указывает, почему простейший член ряда пиридиновых оснований имеет пять атомов углерода. Через год Дьюар (Dewar), независимо от Кернера, пришел к той же формуле, которая затем нашла себе подтверждение и в позднейших работах других химиков. Позже изучением структуры пиридина занимались Томсен, Бамбергер и Пехманн, Чамичан и Деннштедт. В 1879 г. А. Вышнеградский высказал мнение, что, может быть, все растительные основания суть производные пиридина или хинолина, а в 1880 г. Кенигс предлагал даже именем алкалоидов называть только те растительные основания, которые могут быть рассматриваемы, как дериваты пиридина. Однако на настоящее время границы понятия «алкалоиды» значительно расширились.
Получение
Основным источником для получения пиридина является каменноугольная смола.
Химические свойства
Пиридин проявляет свойства, характерные для третичных аминов: образует N-оксиды, соли N-алкилпиридиния, способен выступать в качестве сигма-донорного лиганда.
В то же время пиридин обладает явными ароматическими свойствами. Однако наличие в кольце сопряжения атома азота приводит к серьёзному перераспределению электронной плотности, что приводит к сильному снижению активности пиридина в реакциях электрофильного ароматического замещения. В таких реакциях реагируют преимущественно мета-положения кольца.
Для пиридина характерны реакции ароматического нуклеофильного замещения, протекающие преимущественно по орто-пара положениям кольца. Такая реакционная способность свидетельствует о электроннодефицитной природе пиридинового кольца, что может быть обобщено в следующем эмпирическом правиле: реакционная способность пиридина как ароматического соединения примерно соответствует реакционной способности нитробензола.
Применение
Применяют в синтезе красителей, лекарственных веществ, инсектицидов, в аналитической химии, как растворитель многих органических и некоторых неорганических веществ, для денатурирования спирта.
Безопасность
Пиридин токсичен, действует на нервную систему, кожу.
Пиперидин
|
Пиперидин |
|
|
Традиционные названия |
пентаметиленимин |
|
Химическая формула |
|
|
Молярная масса |
85.15 г/моль |
|
Физические свойства |
|
|
Состояние (ст. усл.) |
жидкость |
|
Плотность |
|
|
Динамическая вязкость (ст. усл.) |
1.573 Па·с(при 20 °C) |
|
Термические свойства |
|
|
Температура плавления |
|
|
Температура кипения |
|
|
Химические свойства |
|
|
Растворимость в воде |
смешивается г/100 мл |
|
Оптические свойства |
|
|
Показатель преломления |
Пиперидин (пентаметиленимин) -- гексагидропиридин, шестичленный насыщенный цикл с одним атомом азота. Бесцветная жидкость с аммиачным запахом, смешивается с водой, а также с большинством органических растворителей, образует азеотропную смесь с водой (35% воды по массе, T кип 92.8°C) Входит в виде структурного фрагмента в фармацевтические препараты и алкалоиды. Получил своё название от латинского названия черного перца Piper nigrum, из которого впервые был выделен.
Впервые пиперидин быль выделен Эрстедом из черного перца в 1819 году. В 1894 году осуществлён его полный синтез Альбертом Ладенбургом и Шолцом
Методы получения
В промышленности в основном гидрированием пиридина над дисульфидом молибдена или никелем при 200 °C в качестве катализатора

Электрохимическим восстановлением
Из пиридина восстановлением натрием в абсолютном этаноле.
Нагреванием пентаметилендиамина дигидрохлорида.
NH 2 CH 2 CH 2 CH 2 CH 2 CH 2 NH 2 *2HCl > C 5 H 10 NH*HCl
Реакционная способность
По своим химическим свойствам пиперидин является типичным вторичным алифатическим амином. Образует соли с минеральными кислотами, легко алкилируется и ацилируется по атому азота, образует комплексные соединения с переходными металлами (Cu, Ni и т.п.). Нитрозируется азотистой кислотой с образованием N-нитрозопиперидина, при действии гипохлоритов в щелочной среде образует соответствующий N-хлорамин C 5 H 10 NCl,
При кипячении пиперидина с концентрированной йодоводородной кислотой происходит восстановительное раскрытие цикла с образованием пентана:
(CH 2) 5 NH + HJ > CH 3 CH 2 CH 2 CH 2 CH 3
При расщеплении исчерпывающем метилировании и расщеплении по Гофману образует пента-1,3-диен.
При нагревании в серной кислоте в присутствии солей меди или серебра пиперидин дегидрируется в пиридин.
Нахождение в природе и биологическая роль
Сам пиперидин выделялся из перца. Пиперидиновый цикл является структурным фрагментом ряда алкалоидов. Так пиперидиновый цикл входит в состав алкалоида кониина, содержащегося в болиголове пятнистом, в состав пиперина, который придаёт жгучий вкус черному перцу. Также в Solenopsin токсине Огненных муравьёв.
Применение
Пиперидин широко используется в органическом синтезе используется в качестве основного катализатора при альдольной конденсации, реакции Кнёвенагеля, как аминный компонент в реакции Манниха и реакции Михаэля.
Пиперидин как высококипящий вторичный амин используется для превращения кетонов в енамины, которые могут быть проалкилированы или проацилированы в б-положение (реакция Сторка).
Безопасность
Токсичен как при попадании на кожу, так и при вдыхании паров. Лекговоспламеним, температура вспышки 16 °C. Работы с ним проводятся в вытяжном шкафу.
Хинолин -- органическое соединение гетероциклического ряда. Применяют как растворитель для серы, фосфора и др., для синтеза органических красителей. Производные хинолина, используют в медицине (плазмоцид, хинин).
Промышленное получение
Хинолин встречается в составе каменноугольной смолы, из которой и добывается.
Методы синтеза
Производные хинолина с заместителями в положениях 2 и 4 можно получить путем конденсации анилина (1) и в-дикетонов (2) в кислой среде. Этот метод получил название «синтез хинолинов по Комба»

Из анилина и б,в-ненасыщеных альдегидов (метод Дёбнера-Миллера). Механизм данной реакции очень близок к механизму реакции Скраупа

Из 2-аминобензальдегида и карбонильных соединений, содержащих б-метиленовую группу (синтез Фридлендера). Метод практически не употребляется из-за низкой доступности о-карбонильных производных анилина

Конденсацией анилина и глицерина в присутствии серной кислоты (метод Скраупа)

Механизм этой реакции точно не установлен, но предполагают, что процесс идет как 1,4-присоединение анилина к акролеину. Акролеин образуется в результате дегидратации глицерина в присутствии серной кислоты (образование акролена подтверждено: из готового акролеина и анилина также образуется хинолин.

Реакция сильно экзотермична, поэтому процесс обычно проводят в присутствии сульфата железа (II). В качестве окислителя используют также оксид мышьяка (V), в этом случае процесс протекает не так бурно,как с нитробензолом и выход хинолина выше.
По реакции Поварова из бензальдегида, анилина и алкена.
Из орто-ацилацетофенона и гидроксида (en:Camps quinoline synthesis).
Из в-кетоанилида (en:Knorr quinoline synthesis).
Из анилина и в-кетоэфиров (en:Conrad-Limpach synthesis).
en:Gould-Jacobs reaction
Токсикология и безопасность
LD 50 для млекопитающих составляет несколько сотен мг/кг.
Морфолин
|
Морфолин |
|
|
Систематическое наименование |
тетрагидрооксазин-1,4 |
|
Традиционные названия |
морфолин |
|
Химическая формула |
|
|
Молярная масса |
87,1 г/моль |
|
Физические свойства |
|
|
Состояние (ст. усл.) |
жидкость |
|
Плотность |
|
|
Термические свойства |
|
|
Температура плавления |
|
|
Температура кипения |
|
|
Химические свойства |
|
|
Растворимость в воде |
смешивается г/100 мл |
|
Токсикология |
|
Морфолин -- гетероциклическое соединение (тетрагидрооксазин-1,4). Химическая формула HN(CH 2 CH 2) 2 O. Используется в органическом синтезе как катализатор в качестве основания (акцептор протона), в частности, для получения геминальных дитиолов. Молекула имеет конформацию «кресла».
Получение
Морфолин получают дегидратацией диэтаноламина или бис (2-хлорэтилового) эфира.

Для очистки его сушат над дриеритом, после чего с осторожностью дробно перегоняют. Рекомендуют также перегонку или высушивание над натрием.
Применение
Промышленность
Морфолин -- ингибитор коррозии. Морфолин -- обычная добавка, в миллионных долях, для регулирования pH как в системах на ископаемом топливе, так и в системах ядерных реакторов. Морфолин применяется из-за его летучести близкой к такой для воды, то есть будучи добавленным в воду, его концентрация в воде и парах одинакова. Его pH регулирующее свойство затем распространяется через парогенератор, обеспечивая защиту от коррозии. Морфолин разлагается медленно в отсутствие кислорода при высоких температурах и давлениях в парообразующих системах.
Органический синтез
Морфолин подвергается большинству реакций характерных для химии вторичных аминов, благодаря наличию атома кислорода, оттягивающего электронную плотность на себя от атома азота, он менее нуклеофильный и менее основный, чем структурно анологичный вторичный амин такой как пиперидин. По этой причине он образует стойкий хлорамин. Он также широко используется для получения енаминов Морфолин широко используется в органическом синтезе. Например, он билдинг блок в получении антибиотика линезолида и противоракового агента Gefitinib.
В исследованиях и в промышленности, дешевизна и полярность морфолина привела к его широкому применению в качестве растворителя для химических реакций.
Безопасность
Морфолин -- легко воспламеняющаяся жидкость. т. всп. 35°С, температура самовоспламенения 230°С. Пары раздражают слизистые оболочки дыхательных путей, при попадании на кожу вызывают жжение. ЛД50 1,65 г/кг (мыши и морские свинки, перорально); ПДК 0,5 мг/м3.